![]()
![]()


UNIVERSITA’ DEGLI STUDI DI PAVIA
FACOLTA’ DI MEDICINA E CHIRURGIA
Radioterapia
ANNO ACCADEMICO 2003-2004
________________________
TRATTAMENTO RADIANTE DELLE
NEOPLASIE PELVICHE
INTRODUZIONE
Il paziente oncologico è trattato clinicamente con mezzi diversi che si prefiggono di togliere, se possibile, la massa tumorale con un intervento chirurgico; di evitare, il più possibile che eventuali cellule malate si diffondano nel corpo del paziente utilizzando la chemioterapia o la radio terapia ed infine di ridurre l’entità della massa tumorale, quando non asportabile, col trattamento radiante.
Ho voluto esaminare e trattare gli aspetti dell’attività del tecnico sanitario nella
Simulazione del trattamento radiante.
Data l’importanza di questo trattamento ho voluto rimarcare alcuni concetti fondamentali della radioterapia per poi passare al funzionamento del simulatore e quanto sia importante la simulazione per una buona riuscita nella cura con le radiazioni. Il tecnico sanitario di radiologia ha un ruolo specifico nella simulazione, ho quindi definito la sua figura.
Ho infine riportato le direttive che il tecnico segue durante una simulazione che riguardano: sia il posizionamento del paziente che i sistemi di immobilizzazione che interessano le principali sedi del tumore.
Ho basato le mie analisi documentandomi sulle tecniche impiegate presso il Servizio di Radioterapia Oncologica dell’IRCCS del Policlinico San Matteo diretto dal professor Pietro Franchini, basandomi anche su quelle proposte dei documenti dell’AIRO, l’Associazione Italiana di Radioterapia Oncologica.
Insieme alla Chirurgia oncologica e alla Oncologia Medica, la Radioterapia oncologica è uno dei pilastri su cui si basa la cura dei tumori.
La radioterapia può essere svolta con diverse finalità:
a- precauzionale che si applica su volumi ad elevato rischio ma clinicamente indenni
b- radicale per l’eliminazione completa della malattia
c- palliativa che serve a migliorare la qualità della vita del paziente ormai inguaribile
d- sintomatica che può alleviare i sintomi che peggiorano lo stato del paziente.
Gli effetti biologici delle radiazioni non interessano solo le cellule neoplastiche ma possono provocare effetti indesiderati anche su tessuti sani causando quindi danni agli organi ed apparati situati in prossimità del tumore. Lo scopo infatti della radioterapia è quello di somministrare alle cellule tumorali una dose di radiazioni sufficiente a provocarne la morte ma deve anche garantire il massimo risparmio dei tessuti sani. Ecco perché è estremamente importante la simulazione effettuata con estrema cura e precisione.
Iniziamo con il ricordare che in radioterapia sono impiegate radiazioni elettromagnetiche ionizzanti, che cioè sono dotate di un’energia tale da dare luogo alla ionizzazione degli atomi. Queste radiazioni possono essere suddivise in due gruppi fondamentali:
radiazioni fotoniche, che sono prive di massa, cui appartengono:
1- le radiazioni x che sono prodotte artificialmente da apparecchi di roentgenterapia (energie che vanno da 50 a 400 KeV) e da acceleratori di particelle (energie che vanno da 4 a 45 MeV)
2- raggi gamma che sono prodotti dal decadimento naturale di isotopi radioattivi come il Co60 che ha energia di circa 1.33 MeV
le radiazioni di energia superiore a 1 MeV vengono considerate di “alta energia” e sono abitualmente impiegate nella cura di neoplasie profonde.
In radioterapia si usano anche radiazioni corpuscolate come gli elettroni ed i protoni che sono particelle subatomiche e vengono prodotte da acceleratori che imprimono loro l’energia di penetrazione necessaria al loro impiego clinico. Talora vengono impiegati anche i neutroni.
Per ogni paziente è necessario stabilire la sede da irradiare ed in base alla stadiazione del tumore si deve definire il volume da trattare. Si esegue il Posizionamento del paziente con il confezionamento di eventuali sistemi di immobilizzazione.
Successivamente si elabora il “piano terapia” che può anche avvalersi dell’uso della TC. L’inizio della terapia è subordinato a una simulazione post piano. La terapia si effettua di solito quotidianamente per cinque giorni la settimana; o con un frazionamento meno frequente fino alla fine della cura. Durante la terapia il paziente viene visitato settimanalmente per verificare gli eventuali effetti collaterali. Alla fine della terapia il paziente verrà controllato con visite periodiche di follow-up per seguire la guarigione o trovare precocemente recidive o localizzazioni a distanza.
La classificazione dei Volumi di trattamento è indicata nel documento ICRU 50 e successive variazioni:
a- volume tumorale macroscopico (Gross Tumor Volume o GTV) costituito da una massa tumorale palpabile, visibile o dimostrabile radiologicamente Il GTV può anche non essere definito, in caso di asportazione chirurgica del tumore primitivo; oppure si possono definire più GTV se esistono adenopatie associate al tumore primitivo. Le metodiche diagnostiche utilizzate per determinare la localizzazione, le dimensioni e la forma del GTV dovrebbero essere indicate nella documentazione del paziente e saranno indicate al TSRM prima della simulazione. Ognuno dei GTV deve essere definito al simulatore.
b- Volume bersaglio clinico (Clinical Target Volume o CTV) che presenta un volume tessutale che contiene un GTV evidenziabile e/o una regione di malattia maligna microscopica che deve essere eliminata. Il CTV è quindi un’entità anatomo-clinica che deve essere definita prima della scelta della modalità di trattamento. C’è da ricordare che i concetti di GTV e CTV sono fondamentali nella procedura della simulazione
c- Volume Bersaglio Pianificato (Planning Target Volume o PTV) in questo caso si usa la radioterapia con fasci esterni, è necessario aggiungere dei margini intorno al CTV per tener conto di movimenti degli organi e del paziente nonché della accuratezza del fascio e dell’incertezza nel posizionamento giornaliero del paziente e di eventuali accessori, esso è un concetto geometrico e serve allo scopo di selezionare dimensioni e caratteristiche dei fasci tali da garantire che la dose prescritta venga effettivamente assorbita dal CTV.
Gli organi a rischio (che sono organi sani la cui radiosensibilità può influenzare in modo significativo la pianificazione del trattamento e/o la dose prescritta) devono in linea di massima essere rispettati dal piano di trattamento.
Gli organi a rischio possono essere suddivisi in tre classi:
a- organi di classe 1 – le lesioni da radiazioni sono fatali o provocano un grave danno
b- organi di classe 2 – le lesioni da radiazioni causano un danno modesto
c- le lesioni da radiazioni sono modeste, transitorie e reversibili provocando un danno non significativo.
Nel caso della definizione del PTV, anche ogni possibile movimento dell’organo a rischio deve essere tenuto in considerazione così come devono esserlo le inesattezze nella preparazione durante l’intero trattamento.
La simulazione ha lo scopo di preparare il trattamento radioterapico utilizzando gli stessi parametri che verranno adoperati sull’unità di terapia e che riguardano:
a- il posizionamento del paziente
b- la distanza fuoco-pelle
c- l’inclinazione dei fasci
d- l’ampiezza dei campi
e- la posizione dei campi
f- l’individuazione degli organi critici
g- la preparazione dei presidi di posizionamento
h- contenzione.
La simulazione viene svolta con l’uso di un apparecchio radiologico che riproduce i movimenti dell’apparecchiatura per radioterapia: esso è dotato di scopia con intensificatore di brillanza e possibilità di radiografia.
Si effettuano due simulazioni:
1- la prima viene effettuata utilizzando parametri standard legati alla sede da irradiare e all’estensione tumorale, in questo momento vengono anche confezionati i sistemi di immobilizzazione e definiti i parametri di posizionamento del paziente
2- la seconda simulazione viene effettuata dopo il piano TC e si riportano i nuovi parametri che sono forniti dall’elaborazione del piano, personalizzati per ciascun paziente: così da avere una definizione dei fasci ottimale al PTV comprendendo tutto il tessuto neoplastico ed escludendo il più possibile gli organi critici.
Dopo aver deciso la tecnica e l’apparecchiatura da utilizzare, si preparano gli eventuali presidi di posizionamento e contenzione e si posiziona il paziente in rapporto al volume da irradiare. In scopia si individua il volume bersaglio clinico o CTV e le strutture anatomiche di riferimento così che con il reticolo mobile all’interno del campo luminoso del simulatore si determinano le dimensioni di ciascun campo da irradiare. Si escludono, da ciascun campo, gli organi critici cioè tutte le strutture che non devono essere irradiate e si costruiscono le eventuali protezioni. Si esegue una radiografia e si segnano, sulla cute del paziente, con una matita dermografica, i limiti dei campi e delle protezioni. Tutte queste operazioni vanno svolte per ogni campo che si intende definire.
Per definire la DFP è indispensabile conoscere l’isocentro della macchina di terapia che verrà scelta e quindi impostare il simulatore utilizzando lo stesso isocentro che è uguale alla distanza che intercorre tra il fuoco della macchina e l’asse di rotazione del gantry (per gli acceleratori lineari è di regola 100 cm mentre per le moderne apparecchiature di cobaltoterapia è di regola 80 cm.) Nella simulazione l’isocentro viene fatto coincidere (ove possibile) con il centro del tumore da irradiare, tale posizione potrà essere modificato nella simulazione definitiva dopo il piano terapia.
A volte basta questa simulazione per definire il volume bersaglio e quindi procedere all’irradiazione del paziente. Altre volte, quando è necessaria una maggiore precisione o ci si trova in prossimità di organi critici, diventa indispensabile elaborare un piano di terapia utilizzando le scansioni TC personalizzate sul paziente che si deve curare attraverso sistemi di pianificazione computerizzata del trattamento TPS.
Per applicare questo procedimento è necessario:
a- effettuare la simulazione iniziale per stabilire un sistema di coordinate che individuano l’isocentro: in questo caso è necessario porre attenzione alla posizione del paziente che deve essere la stessa sia al simulatore che sul lettino della TC. Se durante il trattamento si rendono necessari sistemi di immobilizzazione del paziente, questi devono essere usati anche durante le scansioni TC.
b- Individuare l’isocentro stabilito al simulatore che si ottiene durante le scansioni TC sulla cute del paziente, ponendo dei piccoli reperi radiopachi che non creano artefatti sull’immagine TC. Si procede all’esecuzione dei tomogrammi i cui dati, vengono trasferiti via rete o con dischi magnetici o con CD al sistema per i piani di trattamento dove verranno elaborati.
c- Simulazione finale in cui si riportano i nuovi parametri emersi dalle elaborazioni ed i dati desunti dal piano di terapia al computer: i campi vengono disegnati sulla cute del paziente.
Solo a questo punto il paziente viene inviato alla macchina di terapia dove verranno effettuate gammagrafie per verificare la correttezza dei parametri elaborati prima del ciclo radioterapico. Appurata la corrispondenza dei parametri, la proiezione del centro del campo e degli angoli di riferimento dei campi vengono definitivamente tatuati sulla pelle del paziente.
E’ importante l’elevata qualità della simulazione in quanto necessaria per il raggiungimento di una buona riuscita del trattamento della radioterapia oncologica che dipende dalla accurata preparazione.
Quando non è tecnicamente possibile, per i limiti di dimensioni imposti dal collimatore, quando il volume bersaglio è posto in zone di spessore molto disomogeneo, quando gli assi dei fasci non sono fra loro paralleli e quando il paziente non potrebbe sopportare una dose integrale così alta, è necessario suddividere il volume bersaglio mediante l’impiego di due o più campi adiacenti: in questo caso si fraziona il campo in due o più volumi da irradiare in tempi diversi.
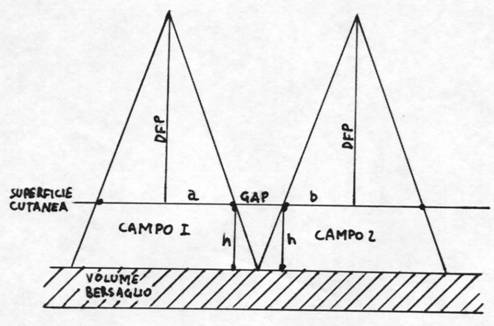
Per il calcolo si deve tener presente che, il volume bersaglio non si trova in superficie ma in profondità e che il fascio è divergente. Se non si considerasse il gap, cioè la distanza che deve essere lasciata tra i campi adiacenti, a livello del bersaglio e degli organi critici, si avrebbe la sovrapposizione dei fasci e di conseguenza un sovradosaggio se fossero troppo vicini, un sottodosaggio se troppo distanti.
Ecco perché il calcolo del gap risulta fondamentale per il corretto posizionamento di campi contigui. Per calcolare il gap bisogna considerare le emilunghezze dei campi, la distanza tra sorgente e pelle (DFP) e la profondità del volume bersaglio. Ne consegue che il gap è uguale alla profondità del bersaglio (h), diviso per la DFP e moltiplicato per l’emisomma dell’ampiezza dei cambi (a+b) secondo lo schema riportato.
a- POSIZIONAMENTO il tecnico sanitario di radiologia medica è l’operatore che ogni giorno deve posizionare il paziente per la terapia: per effettuare questa operazione sono necessarie competenza ed attenzione perché anche un minimo errore in questa fase, compromette la buona riuscita della seduta di trattamento. Non va dimenticato che il tecnico deve possedere grande pazienza perché spesso, il malato, a causa dei dolori o per la rigidità del lettino di trattamento, ha difficoltà a mettersi in posizione.
Per una corretta simulazione del trattamento infatti è necessario che il paziente sia in una:
1- pozisione confortevole che aiuta ad ottenere la piena collaborazione del paziente per evitare che si muova durante la simulazione od il trattamento vanificandone il buon esito.
2- Posizione facilmente riproducibile per ridurre i rischi di un errore durante il posizionamento, un errore che potrebbe comportare errori durante la terapia.
b- DIRETTIVE GENERALI che riguardano la simulazione sono le seguenti:
1- svestire il paziente in rapporto alla sede da irradiare
2- far togliere le scarpe soprattutto nel caso di irradiazione di addome inferiore, pelvi od arti inferiori
3- disporre il paziente sul lettino del simulatore
4- allineare il paziente con il laser sui tre piani: il piano sagittale mediano deve sempre essere, se non altrimenti specificato, in asse con il laser sagittale
5- raccomandare al paziente di essere rilassato senza contrarre nessun muscolo
6- posizionare correttamente il paziente secondo posizioni standard
7- nell’irradiazione del cranio posizionare, se non altrimenti specificato, tenendo per riferimento il piano di Francoforte, che deve essere perpendicolare alla superficie di appoggio del lettino
8- specificare sempre e registrare sulla scheda di simulazione l’uso di eventuali poggiatesta, mezzi di contenzione, bolus od altro
9- istruire il paziente sul corretto posizionamento ed ottenerne collaborazione
10- dare al paziente ogni istruzione supplementare, come la necessità di presentarsi per le successive sedute di radioterapia a vescica vuota o piena, prima o dopo il pasto, con il retto vuoto, in base a quanto scelto nella simulazione e nel piano di terapia.
Al termine della simulazione il materiale e la documentazione che riguardano ogni paziente devono essere ordinati: su ogni radiografia va segnato il nome del paziente, la data e l’angolo di rotazione della testata e del collimatore. Altrettanto accuratamente va compilata la scheda per ogni simulazione effettuata annotando la posizione del paziente, gli eventuali accessori, i parametri del simulatore come la posizione di gantry e collimatore, dimensioni dei campi, distanza fuoco-pelle ed isocentro.
c- POSIZIONAMENTI STANDARD: I posizionamenti tipici da far assumere al paziente sono:
1- decubito supino che consiste nell’appoggio del dorso al lettino, le gambe sono allineate con i talloni che si toccano
2- decubito prono che consiste nell’appoggio del torace al lettino, la testa ruotata a destra o a sinistra, braccia allungate sopra il cuscino, gambe allineate con piedi intraruotati ed alluci che si toccano
3- testa ruotata a destra o sinistra dopo aver allineato tutto il paziente, compresa la testa, si ruota quest’ultima il più possibile verso destra o sinistra
4- braccia sopra la testa le mani devono, se possibile, afferrare i gomiti
5- braccia lungo i fianchi il palmo delle mani deve essere appoggiato al lettino
6- mani incrociate sopra il torace mani sul torace con dita embricate le une nelle altre.
7- Abduzione braccio destro o sinistro con reggibraccio di solito si usa per irradiazione della regione sopraclaveare ed ascellare: il braccio deve essere portato al massimo della abduzione laterale, a 90° rispetto all’asse di allineamento del corpo, in rapporto alla motilità possibile, deve essere appoggiato al reggibraccio e la mano deve afferrarne l’apposita maniglia.
8- Decubito prono per ascella che si usa per irradiare la parte posteriore dell’ascella: il capo va ruotato controlateralmente all’ascella da irradiare e mano omolaterale sotto il pube, distanza tra le cute del torace e la cute del gomito utilizzando appositi distanziatori confezionati in polistirolo e differenti per ogni singolo paziente, tali da mantenere sempre la medesima distanza tra torace e braccio.
E’ importante prestare particolare attenzione al posizionamento in quanto differenze di esso tra simulatore e macchina devono essere corrette durante la simulazione prima dell’inizio del ciclo radioterapico.
d- IMMOBILIZZAZIONE per agevolare il mantenimento della posizione a volte si ricorre a sistemi di immobilizzazione che aiutano il paziente. Questi possono essere:
1- materassini indurenti a vuoto che servono ad immobilizzare il paziente per una certa parte del corpo es. da metà torace ai piedi o nella regione della testa e del collo. Il materassino va adagiato sul lettino, quindi vi si fa coricare il paziente e lo si posiziona secondo le direttive del medico e la sede da irradiare. Si fa aderire con le mani il materassino al corpo del paziente e si collega l’apposita valvola alla pompa aspirante: il vuoto che si crea provoca il forzato collabimento dei granuli di polistirolo contenuti nel materassino che conserverà rigidamente la forma del paziente che ha acquisito. Una volta che il paziente ha completato il ciclo di terapia il materassino potrà essere utilizzato per un altro paziente.
2- Gusci con resine bicomponenti termoindurenti che si usano per l’irradiazione di diverse parti del corpo: questi si preparano con una sagoma grezza di cartone o polistirolo che imita, approssimativamente, la parte del corpo da immobilizzare. L’operatore adagia il paziente nella sagoma e lo posiziona in modo adeguato. Ora si prepara la miscela di schiuma e la si versa all’interno della forma grezza; la schiuma si espande e riempio lo spazio tra il paziente e la forma di cartone: è necessario fare aderire in modo perfetto al corpo del paziente modellandola con le mani. La miscela indurendosi, genera una reazione esotermica che dura circa cinque minuti. Il paziente deve essere informato dell’eventuale fastidio e del calore prima dell’inizio del procedimento al fine di ottenerne la piena collaborazione. Il costo è elevato se paragonato a quello dei materassini indurenti che possono essere riutilizzati mentre i gusci no
maschere termoplastiche che sono adoperate generalmente per l’irradiazione del distretto testa-collo. Sono formate in un foglio di materiale deformabile con il calore ed in grado di mantenere una certa rigidità dopo il raffreddamento.
TSRM
Dopo quanto descritto si evince l’importanza che assume la figura del tecnico sanitario di radiologia medica. Egli infatti è un operatore sanitario in possesso di diploma universitario o di laurea di I livello e dell’iscrizione all’albo professionale.
Nella sua attività lavorativa è responsabile degli atti di sua competenza ed è abilitato a svolgere, in via autonoma o in collaborazione con il medico e le altre figure sanitaria, indagini e prestazioni radiologiche.
Egli è abilitato, su prescrizione medica, a svolgere tutti gli interventi che richiedono l’uso di sorgenti di radiazioni ionizzanti, sia artificiali che naturali, di energie termiche, di ultrasuoni, di risonanza magnetica nonché gli interventi per la protezionistica fisica o per la dosimetria.
Il tecnico di radiologia partecipa anche alla programmazione ed all’organizzazione del lavoro nell’ambito della struttura in cui opera, nel rispetto delle proprie competenze.
E’ anche dovere del tecnico di radiologia adoperarsi perché il reparto in cui opera sia accogliente e funzionale.
RADIOTERAPIA ONCOLOGICA
Il tecnico sanitario di radiologia che opera in un servizio di radioterapia oncologica lo fa direttamente con il medico radioterapisti nello svolgimento di molte attività che sono:
- operazioni dosimetriche che concernono il trattamento che si esegue anche in collaborazione con i fisici sanitari
- effettuazione della simulazione
- preparazione e confezione di eventuali presidi di posizionamento ed immobilizzazione
- preparazione e posizionamento del paziente
- effettuazione del trattamento radioterapico predisposto dal radioterapisti
- tenuta ed aggiornamento dei registri e delle schede di terapia del paziente registrando quotidianamente la dose somministrata.
TECNICA DI IRRADIAZIONE DELLA PELVI
- UTERO
a- Per quanto riguarda la posizione che deve assumere il paziente, questa deve essere supina.
b- In caso di necessità, per l’immobilizzazione del paziente si usano il materassino indurente a vuoto, o guscio di schiuma bicomponente autoindurente
c- DFP cm. 100
d- Tecnica preferita “a box”
e- Organi a rischio: retto, vescica e teste femorali
IL CVT è dato dall’utero e dai linfonodi regionali con un margine di sicurezza geometrica di 2 cm. I limiti di campo sotto elencati dovrebbero essere considerati solo come riferimento perché in realtà vanno adattati alle particolari condizioni di ciascun paziente.
SIMULAZIONE PRIMA DELLA TC PER PIANIFICAZIONE DEL TRATTAMENTO
LIMITI DEI CAMPI:
· Campo frontale
· Craniale: spazio intersomatico tra L4 e L5
· Caudale: margine inferiore dei forami otturatori
· Laterale: 1 cm lateralmente rispetto al piccolo bacino
· Campo laterale
· Limite craniale e caudale rimangono invariati rispetto la campo frontale
· Anteriore: deve includere la sinfisi pubica
· Posteriore: tangente al margine anteriore del sacro
Si devono sagomare i campi in modo da ridurre l’irradiazione delle pareti vescicale e rettale, si deve escludere il più possibile l’intestino tenue dal volume irradiato.
All’inizio della simulazione dopo pianificazione TC si inserisce nella vagina un repere cilindrico radiopaco e nel retto la sonda che servirà, durante la simulazione dei campi laterali, ad introdurre il mezzo di contrasto nell’ampolla rettale.
- VESCICA
a- posizione del paziente: il paziente deve essere supino
b- immobilizzazione del paziente: se necessaria, si utilizza il materassino indurente a vuoto o il guscio di schiuma bicomponente autoindurente
c- DFP : cm. 100
d- Tecnica preferita “a box”
e- Organi a rischio: retto e teste femorali
CVT: è rappresentato dall’intera pelvi e comprende la vescica ed i linfonodi iliaci comuni: si deve mantenere un margine di sicurezza geometrica di 1,5-2 cm
· Campo frontale
· Craniale: spazio intersomatico tra L5 ed S1
· Caudale: margine caudale dei forami otturatori
· Laterale: 1,5-2 cm oltre il margine laterali della pelvi ossea
· Campo laterale
· I limiti craniale e caudale rimangono invariati rispetto al campo frontale
· Anteriore. 1,5 cm anteriormente alla vescica
· Posteriore: margine anteriore del coggice
PROTEZIONI: il volume irradiato non deve includere le teste ed i colli femorali e dovrebbe essere sagomato in modo da ridurre il volume di intestino tenue irradiato e gran parte del retto.
Problemi particolari: in fase di simulazione si devono opacizzare il retto e l’intestino tenue al fine di localizzarli e di utilizzare protezioni idonee.
- PROSTATA
a- Posizione del paziente: supino
b- eventualmente il paziente deve essere immobilizzato con un materassino indurente a vuoto o guscio di schiuma bicomponente autoindurente
c- DFP: cm 100
d- TECNICA PREFERITA: “a box”
e- ORGANI A RISCHIO: retto, vescica e teste femorali
CTV: è rappresentato da prostata, vescicole seminali, linfonodi pelvici; è necessario
rispettare un margine di sicurezza geometrica di 1 cm in tutte le direzioni.
SIMULAZIONE PRIMA DELLA TC PER PIANIFICAZIONE DEL TRATTAMENTO: LIMITI DEI CAMPI:
. Campo frontale:
. Craniale: spazio intersomatico tra L4 e L5
. Caudale: margine inferiore delle tuberosità ischiatiche
. Laterale: 1.5-2 cm lateralmente alle rime pelviche;
. Campo laterale:
. I limiti craniale e caudale rimangono invariati rispetto al campo frontale
. Anteriore: margine anteriore della sinfisi pubica
. Posteriore: comprendente i linfonodi presacrali (S1-S3)
. Protezioni eventuali: bisogna escludere dal volume irradiato la parete posteriore del
retto e la vescica con un’accurata collimazione, con schermi di protezione e campi
personalizzati
. Problemi particolari: in fase di simulazione si devono opacizzare il retto, la vescica e
l’intestino tenue al fine di proteggerli adeguatamente.
RETTO
- Posizione del paziente: prono
- DFP: cm 100
- Tecnica preferita: “a box”
- Organi a rischio: vescica e teste femorali
CTV: è rappresentato dall’intero volume pelvico che comprende la sede della
neoplasia primitiva e i linfonodi infiltrati; calcolando un margine di sicurezza di cm
2 geometrici.
SIMULAZIONE PRIMA DELLA TC PER PIANIFICAZIONE DEL
TRATTAMENTO: LIMITI DEI CAMPI:
. Campo frontale
. Craniale: 1-2 cm superiormente al promontorio sacrale
. Caudale: margine inferiore delle tuberosità ischiatiche
. Laterale: 1-2 cm oltre la parete mediale pelvica
. Campo laterale
. I limiti craniale e caudale rimangono invaritati rispetto al campo frontale
. Anteriore: margine posteriore della sinfisi pubica
. Posteriore: 1.5- 2 cm posteriormente rispetto al margine anteriore del sacro.
. Protezioni: deve essere ridotta l’irradiazione della parete vescicole e deve essere
escluso il più possibile l’intestino tenue dal volume irradiato
. Problemi particolari: la simulazione dopo piano TC e la terapia devono essere
fatte a vescica piena in modo da ridurre il volume di mucosa vescicole irradiato e
da farle comprimere il più possibile l’intestino tenue al di fuori del fascio primario.
Nel caso d’infiltrazione della malattia negli organi circostanti può essere utile
irradiare anche le catene iliache esterne estendendo i campi laterali fino al margine
anteriore della sinfisi pubica. Nei casi di simulazione per terapia preoperatoria
si opacizza il retto con solfato di bario, per la terapia postoperatoria si considerano
come reperi le eventuali clips metalliche posizionate durante l’intervento; è inoltre
utile marcare con un filo di piombo la cicatrice. Nelle donne è vantaggioso
evidenziare la vagina inserendo un repere cilindrico radiopaco (tipo Hegar)
1- AIRO: standard di riferimento nell’irradiazione del cancro del retto: 1998
2- Bentel G C Radiation therapy planning II edizione: Ed. Mc Graw Hill: 1996
3- Documento A.I.R.O. n° 3 Standard minimi nel trattamento del carcinoma prostatico
4- ICRU 50, 1993
5- Rotta P Radioterapia oncologica per TSRM. Torino 1992
6- Decreto Legislativo 26 settembre 1994 n° 746 in Gazzetta Ufficiale, 9 Gennaio 1995.

Tesi :Simulazione del Paziente nel Trattamento Radiante delle Neoplasie Pelviche
di Stefano Berneri
a cura di Maria Richichi